|
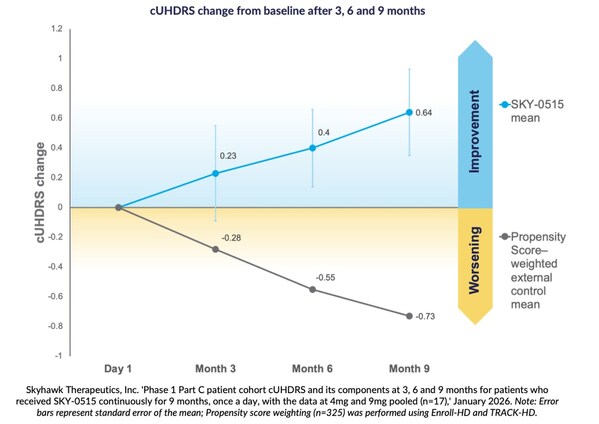
傾向スコアの重み付けに基づいたハンチントン病統一評価スケール(Composite Unified Huntington’s Disease Rating Scale)において、症状のある患者の9か月間の自然歴で予想される悪化点数が-0.73点であるのに対し、本試験の9か月間の所見におけるベースラインからの平均改善点は+0.64点となりました。
Skyhawkはまた、SKY-0515第II相FALCON-HD試験を世界規模に拡大したことを発表しました。現在Skyhawkは、90人以上の患者に薬を投与しています。
ボストン、2026年1月28日/PRNewswire/ –重要なRNAを標的に調節する革新的な低分子創薬に取り組む臨床段階バイオテクノロジー企業のSkyhawk Therapeutics, Inc.は本日、同社の治験薬SKY-0515を使用したハンチントン病(HD)に対する9か月間の中間解析で良好な結果が得られたことを発表しました。
SKY-0515の投与により、血中のmHTTタンパク質は9mgの投与で62%減少し、PMS1 mRNAは26%減少するという用量依存的な効果が明らかとなりました。PMS1は体細胞CAGリピート拡大とHDの病態を左右する重要な要素です。また、SKY-0515は優れた中枢神経系への影響力を示し、全般的に安全で忍容性も良好な結果となりました。
SKY-0515の第I相臨床試験のパートC患者コホートにおいて、SKY-0515を投与した患者は、3か月、6か月、9か月の時点で、ハンチントン病統一評価スケール(cUHDRS)がベースラインから平均して改善したことが示されました。Enroll-HDとTRACK-HDを用いた傾向スコア重み付けに基づく症状のある患者におけるcUHDRSの9か月時点の予想悪化は-0.73点であるのに対し、本試験の9か月時点のプール解析での改善は+0.64点となりました。
ユニバーシティ・カレッジ・ロンドンの神経学教授、Ed Wild氏は、「SKY-0515投与の患者を対象とした第I相パートC試験の安全性データおよび初期有効性データにより、3か月、6か月、9か月時点の事前規定解析において、cUHDRSが自然歴で予想される悪化とは違う結果になることが示され、非常に心強く感じています」と述べました。続けて、「SKY-0515は、これまで患者を対象に試験されたどの治験薬よりもmHTTタンパク質を大幅に減少させることが実証されており、臨床データおよびバイオマーカーデータでは、試験されたすべての用量において良好な忍容性が確認されています。SKY-0515によるmHTTおよびPMS1の減少効果は、ハンチントン病の中核的な発症機序であるこの2つを介した治療において有力な組み合わせとなります。これらの非盲検試験の結果は、現在進行中のプラセボ対照FALCON-HD試験で検証される予定であり、世界中のHD患者にとって、SKY-0515のような経口投与によるハンチンチンタンパク質低減治療薬が真の変革となるという意味において、有意義な影響をもたらすものと期待されます」と述べています。
Skyhawk Therapeutics、研究開発責任者のSergey Paushkin氏は、「第I相試験の目標は、安全性とバイオマーカーの有効性を確立することでした。そして、9か月の中間データ解析ではSKY-0515のバイオマーカー反応が継続的に良好であったこと、また、エンドポイントであるcUHDRSでは、自然歴データの患者のスコアは悪化するのに対し、本試験で改善したことは、SKY-0515がHD患者にとってベストインクラスの疾患修飾薬となる可能性を明確に示しています。これらの中間データはSKY-0515の重要な節目であり、承認された疾患修飾薬が存在しない重篤な疾患に対して、ファーストインクラスの低分子を提供できるSkyhawkの優れたプラットフォームを強調するものとなります。」と述べています。
ハンチントン病はまれな遺伝性の神経変性疾患であり、最終的には死に至ります。米国では4万人以上が罹患しており、世界規模では約数十万人以上が罹患していると推定されています。現在、病気の進行を遅らせたり食い止めたりする承認された治療薬はありません。SKY-0515は、同社の革新的なRNA調節プラットフォームであるSKYSTAR®を用いて開発された経口投与の治験用低分子RNA調節薬です。SKY-0515は、HTTタンパク質およびPMS1タンパク質の両方を治療を目的に減少させます。PMS1は、体細胞CAGリピート拡大とHDの病態を左右する重要な要素であり、変異型HTTを減少させるという利点を補完する要素でもあります。
Skyhawkはまた、オーストラリアとニュージーランドの12施設で実施中のSKY-0515第II相FALCON-HD試験を世界的に拡大したことを本日発表しました。Skyhawkは現在、90人以上の患者にSKY-0515を投与しています。
SKY-0515は臨床試験中の最初のSkyhawk薬品です。
Skyhawkは2027年末までに、承認された疾患修飾薬が存在しない希少神経疾患を治療する低分子医薬品を追加で臨床段階へと進める予定です。
SKY-0515の第I相臨床試験について
SKY-0515の第I相臨床試験は、健康なボランティアおよび早期のハンチントン病(HD)患者を対象とした、SKY-0515の安全性、忍容性、薬物動態、薬力学を評価するよう設計されたヒト初回投与試験です。試験は3つのパートに分けて実施されます。パートAおよびBでは、健康なボランティアを対象にSKY-0515が評価されます。パートCは、早期HD患者(HD-ISSステージ1、2、または軽度のステージ3)を対象に行われる二重盲検プラセボ対照並行デザイン試験です。SKY-0515とプラセボを2種類の用量レベルで84日間投与し、その後12か月間すべての参加者に低用量または高用量のいずれかのSKY-0515を盲検下で投与する積極的治療が行われます。試験の目的は、変異HTTタンパク質とPMS1 mRNAの評価です。SKY-0515のパートCにおける最初の患者への投与は2025年1月に実行されました。SKY-0515試験の第I相Cの組入れは完了しています。
SKY-0515第II相FALCON-HD臨床試験について
FALCON-HD (NCT06873334)は、オーストラリアおよびニュージーランドの12施設にわたるステージ2およびステージ3初期のHD患者120人、ならびに世界40以上の施設におけるステージ2およびステージ3初期のHD患者400人を対象に、SKY-0515の薬力学、安全性、有効性を評価する第II相ランダム化二重盲検プラセボ対照用量設定試験です。対象患者は、SKY-0515を1日1回、3段階の用量のうち1つ、またはプラセボを経口投与されます。治療期間は12か月以上です。本試験の目的は、SKY-0515がRNAスプライシングを調節し、ハンチントン病の病態に関与するmHTTタンパク質およびPMS1タンパク質を減少させる潜在性の評価です。参加施設や適格基準を含むFALCON-HDに関する詳細情報は、ClinicalTrials.govおよびwww.FALCON-HD.comでご確認いただけます。
Skyhawk Therapeuticsについて
Skyhawk Therapeuticsは臨床段階バイオテクノロジー企業です。独自のプラットフォームであるSKYSTAR®を用いて、世界でも特に難病とされる疾患に対する低分子RNA調節薬を発見・開発しています。詳しくはwww.skyhawktx.comをご覧ください。
Skyhawkお問合せ先
Maura McCarthy
コーポレートデベロップメント責任者
maura@skyhawktx.com
写真- https://mma.prnasia.com/media2/2870056/Skyhawk_Therapeutics_9_MONTH_DATA_Graph.jpg?p=medium600
ロゴ- https://mma.prnasia.com/media2/710814/Skyhawk_Therapeutics_Logo.jpg?p=medium600